Wednesday, February 11, 2015
On 7:18 AM by Unknown No comments
Konsep oksidasi reduksi berdasarkan kenaikan dan penurunan bilangan oksidasi. Bilangan oksidasi merujuk pada jumlah muatan yang dimiliki suatu atom dalam molekul (senyawa ionik) jika elektron-elektronnya berpindah seluruhnya.
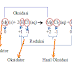
Contoh:
Berdasarkan contoh reaksi diatas dapat disimpulkan bahwa oksidasi adalah kenaikan dalam bilangan oksidasi (naiknya bilangan oksidasi H yang mulanya 0 menjadi +1) sedangkan reduksi adalah penurunan dalam bilangan oksidasi (turunnya bilangan oksidasi dari Cl yang mulanya 0 menjadi -1).
Adapun aturan-aturan untuk menentukan bilangan oksidasi adalah sebagai berikut :
Dalam unsur bebas (yaitu dalam keadaan tidak bergabung atau berdiri sendiri), setiap atom memiliki bilangan oksidasi nol.
- Untuk ion-ion yang tersusun atas satu atom saja, bilangan oksidasinya sama dengan muatan ion tersebut.
- Semua logam alkali/golongan IA memiliki bilangan oksidasi +1, dan semua logam alkali tanah/golongan IIA memiliki bilangan oksidasi +2 dalam senyawanya.
Bilangan oksidasi hidrogen adalah +1,
- Tetapi dalam hidrogen peroksida (
) , bilangan oksidasinya adalah -1.
Unsur halogen memiliki bilangan oksidasi -1 dalam semua senyawanya.
- Ketika halogen-halogen tersebut bergabung dengan oksigen misalnya dalam asam okso dan anion okso maka memiliki bilangan oksidasi positif.
- Dalam molekul netral, jumlah bilangan oksidasi semua atom penyusunnya harus nol.
Contoh: ; 2 ( biloks K) + (biloks C) + 3 ( biloks O) = 0
2 (+1) + 4 + 3 (-2) = 0
+2 + 4 + (-6) = 0
- Dalam ion poliatomik, jumlah bilangan oksidasi semua unsur dalam ion tersebut harus sama dengan muatan total ion.[1]
Contoh:
+7 + 4 (-2) = -1
+7 + (-8) = -1
[1] Raymond Chang. KIMIA DASAR I. (Jakarta : Erlangga.2004).Hlm 101-102
Subscribe to:
Post Comments (Atom)
Search
About Me
Popular Posts
-
Konsep oksidasi-reduksi berdasarkan pelepasan dan pengikatan oksigen. Berdasarkan konsep yang pertama : Oksidasi adalah peri...
-
Buah apel yang telah diiris dan dibiarkan pada ruang terbuka akan menyebabkan perubahan warna pada apel menjadi kecoklatan. S...
-
Konsep oksidasi-reduksi berdasarkan pelepasan dan penerimaan elektron. Pelepasan dan penerimaan elektron terjadi secara simultan, artinya j...
-
Menurut sejarah, kata oksidasi merupakan gabungan dari sebuah unsur dengan oksigen menghasilkan oksida, dan kata reduksi merupakan ...
-
Partikel (unsur, ion, atau senyawa) yang dapat mengoksidasi partikel lain disebut pengoksidasi atau oksidator , tetapi ia sendiri t...
-
Konsep oksidasi reduksi berdasarkan kenaikan dan penurunan bilangan oksidasi. Bilangan oksidasi merujuk pada jumlah muatan yang dimiliki...
-
Percobaan Konsep Reaksi Oksidasi-Reduksi Perhatikan video praktikum di bawah ini dengan seksama, dan lakukanlah percobaan sesuai apa ya...
-
Tugas Kelompok (Portofolio) Buatlah artikel mengenai peranan/aplikasi dari konsep reaksi oksidasi-reduksi di sekitar kalian semenarik...
-
Memuat...
-
PERANAN KONSEP REAKSI OKSIDASI-REDUKSI PADA KEHIDUPAN SEHARI-HARI Semua konsep reaksi oksidasi-reduksi sudah anda pelajari, un...
Recent Posts
Sample Text
Blog Archive
-
▼
2015
(14)
-
▼
February
(13)
- EVALUASI
- PRAKTIKUM
- Tugas Kelompok (Portofolio) Buatlah artikel ...
- Form Upload Tugas Portofolio
- Diskusi
- Pengoksidasi dan Pereduksi
- REFLEKSI
- Kurikulum
- Berdasarkan Kenaikan dan Penurunan Bilangan Oksidasi
- Berdasarkan Penerimaan dan Pelepasan Elektron
- Pendahuluan
- Berdasarkan Pengikatan dan Pelepasan Oksigen
- Pengenalan Konsep Oksidasi-Reduksi
-
▼
February
(13)
Powered by Blogger.





0 comments:
Post a Comment